|
El costo de cada
tratamiento de 24 semanas con la asociación DACLATASVIR+ASUNAPREVIR
(Daklinza+Sunvepra de BMS),
supera los COP 90 millones
(sin incluir los costos de intermediación y gastos del recobro al Fosyga). En
los hechos, Bristol
Myers Squibb estaría acumulando ganancias con:
- Una asociación que no debió registrarse para "uso concomitante obligatorio"
- Un producto que debió retirarse al mismo tiempo que en EEUU (el 6 de
octubre de 2014, cuando BMS retiró la NDA-New Drug Applications 206844 ante
la FDA)
- Un medicamento que no debió protegerse con Decreto 2085 ni debió avalarse
por el IETS (o por lo menos debió corregirse a tiempo y aún no se corrigió)
- Una asociación cuyos precios debieron regularse o negociarse oportunamente.
El INVIMA, que expidió la Resolución No. 2015029104
de 27 de Julio de 2015 AR,
por lo menos debería llamar a revisión de oficio a SUNVEPRA
(Asunaprevir) y las autoridades regulatorias, deberían hacer algo para contener
esta posible pérdida de 9.000 millones trimestrales.
Por estos hechos, la Veeduría ciudadana VCACELAPSS radicó un derecho de
petición ante el Ministerio de Salud, para conocer el monto de los recobros con
ASUNAPREVIR + DACLATASVIR y la pertinencia de su uso. Y como ya se dijo, al no recibir
respuesta, inició una acción de tutela que está próxima a definirse (ver derecho
de petición y radicado).
2.
Del retiro de Telaprevir (Incivo de Janssen) a la entrada de Simeprevir (Olysio
del mismo Janssen)
El gráfico N°2 muestra una captura de la pantalla de seguimiento de TELAPREVIR (Incivo de Janssen)
donde puede apreciarse que el precio de cada empaque de este producto se
mantuvo por encima de 19 millones.
Las ventas de este producto,
subieron de COP 2.224 millones el 2012 a COP 11.139 millones el
2013 sugiriendo un éxito inicial, pero luego bajaron a COP 5.353 millones
en 2014, COP 2.966 millones el 2015 y COP 216 millones el 2016,
sugiriendo un evidente fracaso mercadotécnico.
Es otras palabras, Telaprevir (Incivo de Janssen)
ingresó en Colombia como una prometedora innovación científica y -solo un
par de años después- se convirtió en una gran decepción. Hoy su registro
sanitario muestra la frase "Pérdida de Fuerza Ejecutiva" y el caso
se cerró con una pérdida de COP 21.712 millones para el sistema de
salud (ver gráfico N°2).
Estos hechos muestran un caso
de cuestionable "innovación científica" que ingresó con protección
de Decreto 2085 o "patente express", se vendió sin ningún tipo
de regulación o negociación de precios y tuvo que ser retirado en corto
tiempo (cuando incluso la protección otorgada aún no había vencido). Un
caso de falsa innovación tecnológica que significó una ganancia de COP
21.712 millones para Janssen y una pérdida aún no cuantificada en
recursos del sistema, salud y vida de pacientes (ver Alerta
INVIMA y Derecho de petición de Veeduría VCACELAPSS).
Casos como éste, de
innovación tecnológica fallida, que implican grandes pérdidas para el
sistema (en términos económicos y de salud) se evitarían al aplicarse el
Artículo 72 de la Ley
1753 de 9 de junio 2015 (Plan Nacional de Desarrollo 2014-2018) que
faculta al Ministerio de Salud y al INVIMA para exigir evaluaciones
científico-económicas en el proceso del registro sanitario. Lamentablemente
-a 15 meses de expedida la Ley- el Artículo 72 aún no se encuentra
reglamentado y además, tiene una demanda de inconstitucionalidad interpuesta
por AFIDRO (gremio de las multinacionales farmacéuticas) ante la Corte
Constitucional.
Gráfico 2: Pantalla de seguimiento de TELAPREVIR (Incivo de Janssen) con
comentarios sobre precios y ventas según Sismed 2012 a 2016 (2°trim.)
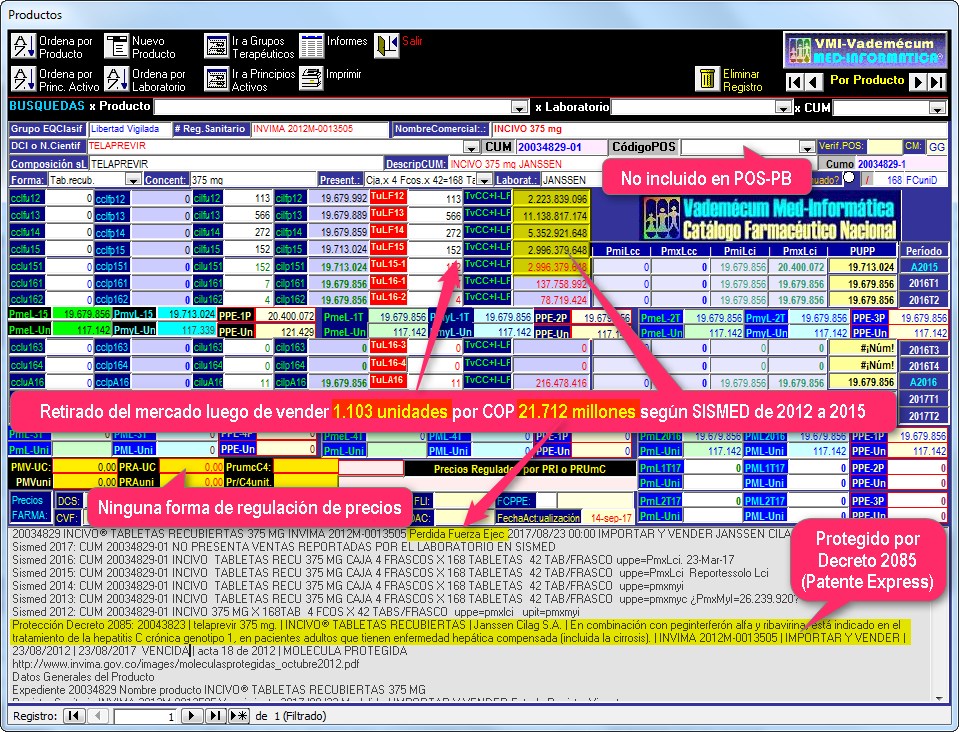
Las ventas de INCIVO, subieron de COP 2.224
millones el 2012 a COP 11.139 millones el 2013 sugiriendo un éxito
inicial, pero luego bajaron a COP 5.353 millones, COP 2.966 millones
el 2015 y COP 216 millones el 2016, sugiriendo un evidente fracaso
mercadotécnico. Este producto fue retirado antes del vencimiento de su
protección por Decreto 2085 (5 años de "patente express"),
después de haber vendido COP 21.712 millones, sin ninguna regulación
de precios.
Sobre
SIMEPREVIR (Olysio
del mismo Janssen)
Este
mismo laboratorio tiene ahora registro sanitario concedido por Resolución
INVIMA No. 2015028303 de 21 de Julio de 2015 para el producto OLYSIO,
que también goza de protección al uso de la información no divulgada de que trata el Decreto 2085 de 2002 (o "patente express").
OLYSIO aún no reporto precios y ventas a SISMED (hasta junio de 2016)
pero el precio
pactado en España el 2014 fue de 25.000 Euros cada
tratamiento de 12 semanas (COP 97.590.000 al cambio de COP
3.253 por Euro) y llegó a 66.000 dólares comercializado
por Johnson & Johnson en EEUU (COP 191.004.000 al
cambio de 2.894 por dólar).
El sistema de salud está
indefenso,
porque solo 500 tratamientos con Olysio -estimando con los precios pactados por
España el 2014- equivaldrían a la UPC de
70.768 pacientes del régimen contributivo. NOTA:
Con este cálculo, no se cuestiona el derecho fundamental a la salud de
500 posibles usuarios de Olysio, sino la pertinencia y racionalidad
científico-económica del gasto, con recursos
destinados a 70.768 pacientes. Ver DP de la Veeduría VCACELAPSS. |
3.
Retiro de Boceprevir (Victrelis de Merck-MS&D) y entrada de Grazoprevir+Elbasvir (Zepatier del mismo Merck-MS&D)
El gráfico N°3 muestra una captura de la pantalla de seguimiento de BOCEPREVIR
(Victrelis de Merck-MS&D)
donde puede apreciarse que el precio de cada empaque de este producto se
mantuvo por encima de 6.500.000 según reportes a SISMED de los años
2012 a 2015.
Las ventas de Victrelis, pasaron de COP
6.035 millones el 2012, a COP 4.848 millones el
2013, COP 3.115 millones el 2014, COP 2.197 millones el 2015 y COP
54 millones el 2016, cuando su registro sanitario fue cancelado.
Es otras palabras, Boceprevir
(Victrelis de Merck-MS&D) se convirtió en otra decepcionante innovación "innovación científica" que ingresó con protección
de Decreto 2085 o "patente express", se vendió sin ningún tipo
de regulación o negociación de precios y tuvo que ser retirado en corto
tiempo (cuando incluso la protección otorgada aún no había vencido). Otro caso de falsa innovación tecnológica que significó una ganancia de COP
16.125 millones para Merck-MS&D y una pérdida aún no cuantificada en
recursos del sistema, salud y vida de pacientes (ver Derecho de petición de
la Veeduría VCACELAPSS).
Otra vez, casos como éste, de
innovación tecnológica fallida que implican grandes pérdidas para el
sistema (en términos económicos y de salud), se evitarían al aplicarse el
Artículo 72 de la Ley
1753 de 9 de junio 2015 (Plan Nacional de Desarrollo 2014-2018) que
faculta al Ministerio de Salud y al INVIMA para exigir evaluaciones
científico-económicas en el proceso del registro sanitario. Lamentablemente
-a 15 meses de expedida la Ley- el Artículo 72 aún no se encuentra
reglamentado y tiene una demanda de inconstitucionalidad interpuesta
por AFIDRO (gremio de las multinacionales farmacéuticas) ante la Corte
Constitucional.
Gráf.3:
Pantalla de seguimiento BOCEPREVIR (Victrelis de Merck-MS&D) con
comentarios sobre precios y ventas según Sismed 2012 a 2016 (2°trim.)
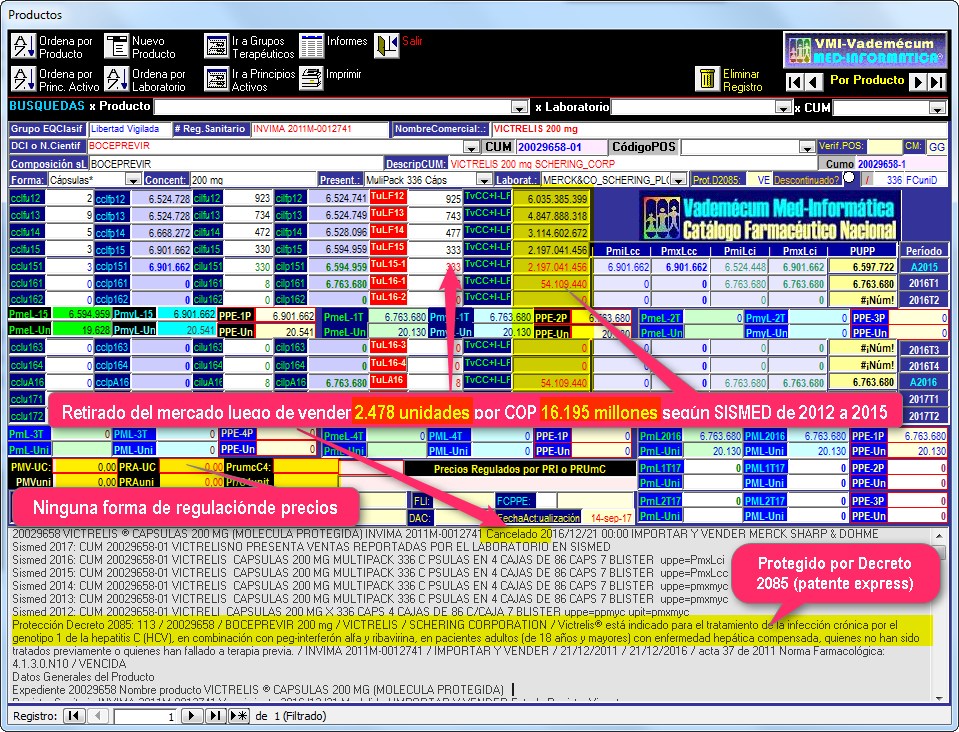
Las ventas de VICTRELIS, pasaron de COP 6.035 millones el 2012, a COP
4.848 millones el
2013, COP 3.115 millones el 2014,
COP 2.197 millones el 2015 y COP 54 millones el 2016, cuando su
registro sanitario fue cancelado. Este producto también fue retirado antes del vencimiento de su
protección por Decreto 2085 (5 años de "patente express") y después de haber vendido COP
16.195 millones, sin ninguna regulación ni negociación de precios.
Sobre GRAZOPREVIR
+ ELBASVIR (Zepatier de Merck-MS&D)
A finales de enero de 2016 se hizo pública la aprobación de la FDA
para ZEPATIER
de Merck-MS&D, una asociación de Grazoprevir + Elbasvir, con y
sin Ribavirina, para tratar la Hepatitis C genotipos 1 y 4.
Previsiblemente, el laboratorio introducirá este medicamento en
Colombia y buscará recuperar los pacientes de Victrelis y conseguir
nuevos candidatos para este tratamiento. Con ZEPATIER se recomienda 12 semanas de tratamiento con un costo que Merck fijó en
54.600 dólares americanos (COP 158.012.400 al
cambio de 2.894 por dólar).
Solo 500 tratamientos con
Zepatier a este costo equivaldrían a la UPC
de
114.583 pacientes del régimen contributivo. NOTA:
En este cálculo, no se cuestiona
el derecho fundamental a la salud de 500 posibles usuarios de
Zepatier, sino la pertinencia y
racionalidad científico-económica del gasto, con recursos
destinados a 114.583 pacientes del régimen contributivo. |
4.
Asociación DASABUVIR+OMBITASVIR+PARITAPREVIR+RITONAVIR (Viekira de Abbvie) a
COP 30 millones cada empaque
El gráfico N°4 muestra una captura de la pantalla de seguimiento de la
asociación fija DASABUVIR+OMBITASVIR+PARITAPREVIR+RITONAVIR (Viekira de
Abbvie)
donde puede apreciarse que este producto comenzó a reportar precios y ventas
el año 2016, con un precio de COP 30.706.667 por
cada empaque.
Nótese que con la venta de
solo 191 empaques, Viekira de Abbvie reportó ventas por COP 5.865 millones
en solo dos trimestres de 2016 (sin ninguna regulación de precios) y que la FDA
emitió alerta por hepatotoxicidad que el INVIMA no reprodujo (ver
Derecho de petición de la Veeduría VCACELAPSS).
Gráfico N°4: Pantalla de seguimiento de VIEKIRA PAK de Abbvie con
comentarios sobre precios y ventas según Sismed 2016 (1° y
2°trimestre)
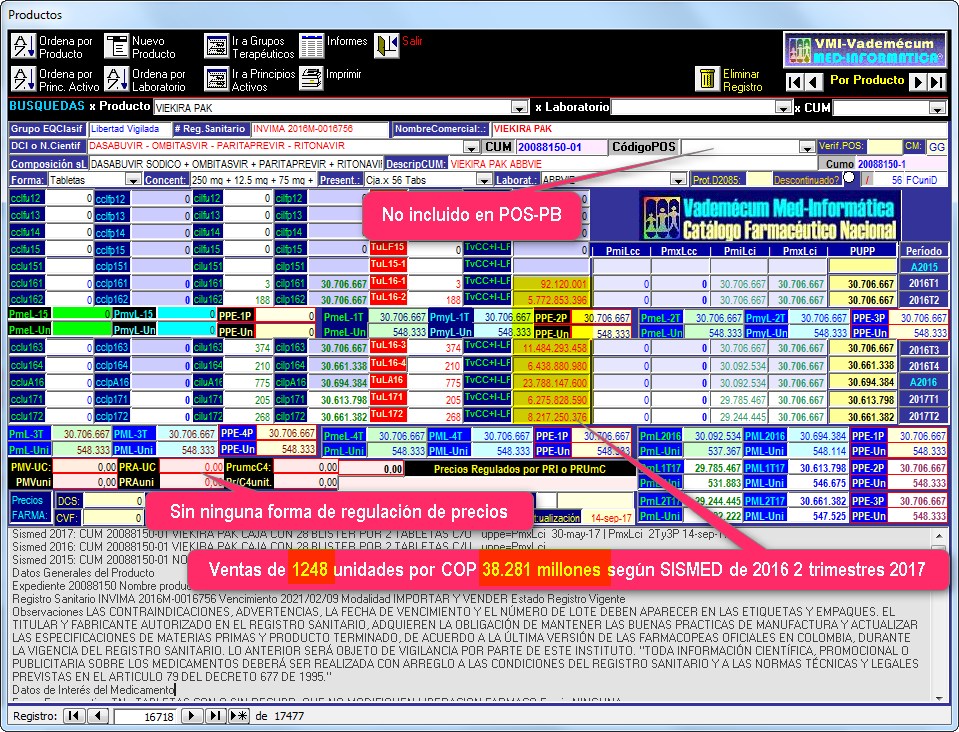
VIEKIRA PAK contiene dos tipos de tabletas, las de color rosado contienen
Ombitasvir, Paritaprevir y Ritonavir y las de color castaño contienen sólo
Dasabuvir. La caja para un tratamiento de cuatro semanas contiene 28 Blíster con 2 tabletas recubiertas de ombitasvir
12.5mg + Paritaprevir 75mg + Ritonavir 50mg y 2 tabletas recubiertas de Dasabuvir 250mg.
Los tratamientos de 12 semanas requieren 3 cajas a un costo ex-factory de COP 92.120.001
y los casos de 24 semanas COP 184.240.402 (sin incluir costos de
Ribavirina cuando este producto se incluye y sin costos de intermediación ni
gastos del recobro).
| Comparando
este costo con los casos de los puntos 2 y 3, resulta que 500 tratamientos
de 12 semanas con Viekira Pak equivalen a la UPC de
66.801 pacientes del régimen contributivo y cuando se requieren 24
semanas, a la UPC de
133.602 pacientes. Reiteramos
que en este cálculo, no se cuestiona
el derecho fundamental a la salud de 500 posibles usuarios de Viekira
Pak, sino la pertinencia y
racionalidad científico-económica del gasto, con recursos
destinados a 66.801 o 133.602 pacientes del régimen contributivo. |
5.
La llegada de Sovaldi y Harvoni de Gilead y después Epclusa la
"pangenotípica"
La Sala especializada de medicamentos y productos biológicos de la Comisión revisora,
en Acta N°08 de 28, 29, 30 y 31 de marzo de
2016, acaba de aprobar el SOFOSBUVIR (Sovaldi de Gilead) y seguramente en
los reportes a SISMED del 3° o 4° trimestre de 2016 conoceremos el precio al
que se comercializará en Colombia. Por el momento, ya sabemos que ingresará
con protección del Decreto 2085 (o "Patente express") y que este
medicamento se hizo mundialmente famoso porque en EEUU se llamó "la
píldora de los 1.000 dólares" (ver Nota
de El Espectador) y porque implementó varias formas de licenciamiento (ver).
La asociación de SOFOSBUVIR
con LEDIPASVIR (Harvoni de Gilead) también acaba de ser aprobada en Acta
N°12 de 16, 17, 18 y 19 de mayo de 2016 e igualmente la S ala especializada de medicamentos y productos biológicos de la
Comisión revisora "recomendó declarar el principio activo ledipasvir como nueva entidad química a la luz del Decreto 2085 de
2002".
Finalmente, la asociación de
SOFOSBUVIR con VELPATASVIR (Epclusa de Gilead) la "pangenotípica"
acaba de ser aprobada
por la FDA para tratar a "pacientes adultos con infecciones crónicas por el virus de la hepatitis C (VHC) con o sin cirrosis (hepatopatía
avanzada)". En el caso de los pacientes con cirrosis de moderada a grave (cirrosis descompensada),
Epclusa está aprobada para usarse en combinación con la Ribavirina. Es
pangenotípica porque es la primera diseñada para tratar los seis genotipos principales del VHC.
Dice la nota de la FDA:
"La seguridad y la eficacia del Epclusa durante 12 semanas se evaluó en tres ensayos clínicos en fase III en los que participaron 1,558 sujetos sin cirrosis o con cirrosis compensada (cirrosis leve). Los resultados demostraron que entre el 95 y el 99 por ciento de los pacientes que recibieron el Epclusa no tenían un nivel detectable del virus en la sangre 12 semanas después de terminar el tratamiento, lo que sugiere que las infecciones de los pacientes se habían curado. La seguridad y la eficacia del Epclusa también se evaluó en un ensayo clínico en el que participaron 267 sujetos con cirrosis descompensada (cirrosis de moderada a grave), 87 de los cuales recibieron el Epclusa en combinación con ribavirina durante 12 semanas, y el 94 por ciento de estos pacientes no tenían un nivel detectable del virus en la sangre 12 semanas después de terminar el
tratamiento".
No pregunten el costo, ni se
pongan a calcular a cuántas UPC de pacientes del régimen contributivo
equivale.
En conclusión, estamos frente a un
"tsunami" de tratamientos millonarios para hepatitis C y otras
patologías de ultra alto costo y el sistema
de salud está indefenso. Las virtudes de este sistema se
salvarán, solo si:
- Las farmacéuticas dejan de seguir cobrando precios exorbitantes, sin
ninguna regulación, control o negociación,
- El gobierno deja de seguir demorando tanto en la implementación de las
medidas vitales que diseñó (Decreto de Biotecnológicos, Artículo 72 del
PND, etc.),
- Los organismos de inspección, vigilancia y control, dejan de seguir en la
misma actitud indolente de los tiempos del crecimiento exponencial de
recobros,
- Las entidades directamente involucradas (IETS, INVIMA, Cuenta de Alto Costo,
etc.) enfatizan más en las tareas que la supervivencia del sistema les exige,
- Las sociedades científicas y asociaciones de pacientes se comprometen
-además- con la defensa de las virtudes de este sistema.
Las organizaciones de la
sociedad civil, estamos en la obligación de avanzar más en las iniciativas
de defensa del bien común.
Envíe sus aportes y
comentarios a observamed.fmc@gmail.com
o trine con @OBSERVAMED
Sobre
conflictos de interés:
La iniciativa "Elijamos
Sabiamente" de la Federación
Médica Colombiana FMC y el Colegio
Nacional de Químicos Farmacéuticos de Colombia CNQFC, no recibe ninguna retribución monetaria, ni en
especie, de ninguna entidad pública ni privada, que pueda comprometer
la independencia de sus investigaciones e informes.
|