FMC-OBSERVAMED:
Casos y cosas de la Actualización POS 2013.
Informe N°1
Se
incluyen opciones biotecnológicas para el tratamiento de Artritis
Reumatoide y limitan indicaciones incluidas de varios Oncológicos |
|
|
|
El 18 de diciembre pasado, el Presidente Santos anunció la inclusión de 70 nuevos tratamientos
en el Plan Obligatorio de Salud (POS) y la aplicación de control de precios a 334 medicamentos
(ver Nota
y Video) "Quedan incluidos prácticamente todos los tratamientos para el cáncer de mama, para el cáncer gástrico, para el cáncer de próstata –el cáncer que yo sufrí y por fortuna estoy totalmente curado–, el cáncer de colon, que están entre las principales causas de mortalidad en el
país", dijo. En su anuncio, el Presidente mencionó también los nuevos tratamientos
para Artritis Reumatoide (ver Otra
Nota). Al respecto, publicamos en este Boletín el
Informe N°1 de OBSERVAMED y la Federación Médica Colombiana sobre casos y cosas de la Actualización POS
2013 que rige a partir de enero de 2014.
Este
Informe sobre "Inclusiones POS 2013" se presenta en varios Boletines semanales que
se reunirán en un Informe final y una petición de aclaraciones al
Ministerio de Salud, con copia a la Sala de Seguimiento de la Sentencia T-760
de la Corte Constitucional, la Defensoría, la Contraloría General, PGN y demás
organismos de control. 1.
Inclusión de Biofármacos para tratamiento de Artritis Reumatoide
Seguramente, una de las decisiones más importantes de la Resolución 5521 de
2013, es la inclusión de seis (6)
Biofármacos, para el "Uso en Artritis Reumatoide refractaria a
tratamiento con fármacos anti-reumáticos modificadores de la enfermedad
(FARME) no biológicos". Ver Tabla N°1. Tabla
N°1: Biofármacos incluidos en la Actualización Integral del POS 2013
| N° |
Molécula,
Marca y Laboratorio |
TotalVentas2012 |
Observaciones |
| 849 |
ABATACEPT,
ORENCIA de BRISTOL_MYERS_SQUIBB |
26.475.342.480 |
Monopólico.
Fue protegido por Decreto 2085 |
| 850 |
ADALIMUMAB,
HUMIRA de ABBOTT |
75.511.916.499 |
Monopólico.ExProtegidoD2085 |
| 851 |
CERTOLIZUMAB,
CIMZIA de BIOPAS |
26.644.900.711 |
Monopólico.ExProtegidoD2085 |
| 852 |
GOLIMUMAB,
SIMPONI de JANSSEN |
1.321.101.600 |
Monopólico.Protegido D.2085 |
| 853 |
INFLIXIMAB,
REMICADE de JANSSEN |
52.201.196.095 |
Monopólico.¿Y Enf.de CROHN? |
| 854 |
TOCILIZUMAB,
ACTEMRA de ROCHE |
18.678.653.688 |
Monopólico.Protegido D.2085 |
La
inclusión de estos medicamentos en el POS es particularmente importante, porque
cambia el manejo de la Artritis Reumatoide en el sistema de salud
Colombiano, por cinco hechos que mencionamos a continuación: 1.1.
Se trata de Biofármacos monopólicos protegidos por Decreto 2085
Nótese en la Tabla N°1 que estos medicamentos que se incluyen en el POS 2014
son:
- Biofármacos,
- Monopólicos,
- De alto costo y
- Estuvieron -o estan- protegidos por el Decreto 2085 de
protección de datos de prueba o "patente express".
Estos medicamentos que eran objeto de recobro y
se habían convertido en otra fuente de financiación de las EPS, ahora se
pagarán con fondos de la UPC que el sistema les entrega para su
administración. 1.2.
Estos Biofámacos fueron objeto de millonarios recobros y prácticas de inducción a la demanda
Nótese también en la Tabla N°1 que el año 2012, estos productos reportaron
ventas por más de COP 200.000
millones. A esta suma debe añadirse la parte correspondiente a esta
indicación de los COP 93.446 millones que reportó RITUXIMAB (Mabthera
de Roche).
Para nadie es un secreto
que las ventas de estos productos crecieron exponencialmente y que ese
fenómeno no se relaciona con cambios epidemiológicos de la Artritis
Reumatoide
en Colombia, sino con prácticas de inducción a la demanda que adelantan los
laboratorios, que se retroalimentan con los beneficios que las EPS pueden
obtener cuando recobran estos medicamentos. 1.3. Prácticamente se
incluyeron en el POS todas las opciones farmacológicas para el tratamiento de
la Artritis
Reumatoide
|
|
|
|
Tabla N°2 Recursos
Terapéuticos en Artritis Reumatoide
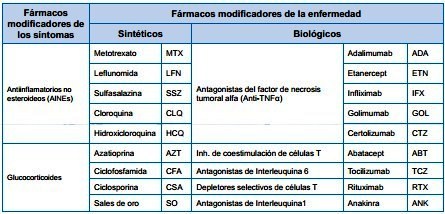 |
Si tomamos en cuenta una tabla
didáctica de recursos terapéuticos para la Artritis Reumatoide
presentado en el 7° Encuentro Internacional de Farmacovigilancia (ver
AR) resulta evidente que prácticamente todas las opciones para el manejo
farmacológico de la Artritis Reumatoide están ahora incluidas en el
Plan Obligatorio de Salud POS. Ninguna de las alternativas que
quedaron por fuera puede considerarse irreemplazable por medio de los
recursos incluidos en el POS.
Puede decirse que en este caso
concreto, el regulador emitió una norma que sí cubre todo el espectro
terapéutico para una patología. |
1.4. Cambia el rol de las
EPS: No podrán recobrar esos productos y deben asumir esos costos con
cargo a la UPC
Al incluirse todas las opciones farmacológicas para esta patología en el
POS, cambia el rol de las EPS: Antes, las EPS debían suministrar estos
biofármacos
tanto por decisión de los CTC (Comités Técnico Científicos) como por
Tutela y luego recuperaban esos costos mediante recobros al FOSYGA. Ahora, las
EPS no pueden recobrar estos biofármacos y deben suministrarlos con cargo a la UPC (Unidad de Pago
por Capitación o fondos públicos que se entregan a las EPS, para su
administración).
En términos de mercado, antes, estos
productos tenían protección, libertad de precios y la posibilidad
de ser recobrados a precios exorbitantes. Ahora, aunque todavía no se resolvió el
problema de monopolios y abusos de posición dominante, los precios están
regulados y -así sea con aumento de la UPC- son las EPS las que tendrán que
asumir los costos de la inducción a la demanda, con la UPC o los fondos que
administran.
1.5. ¿Se trata de un
avance hacia el
uso racional de biofármacos en el
tratamiento de la Artritis Reumatoide?
Esa parecería ser la apuesta del equipo técnico que trabajó en esta
actualización del POS. Eliminar los estímulos perversos que convertían a
las EPS en parte del problema, puede ser una buena idea. Pero ¿será
posible neutralizar la avidez comercial y las prácticas de inducción a la
demanda que las farmacéuticas adelantaron en los últimos años? ¿podrá
contenerse la experticia en litigio que generó cerca COP 250.000 millones
anuales a las farmacéuticas de biofármacos monopólicos? ¿se neutralizarán
entre sí las prácticas de inducción a la demanda de las farmacéuticas con
las prácticas de negación de atención de las EPS?. La experiencia que se
recoja en este caso puede ser de mucha utilidad en el manejo de otras
patologías por el SGSSS.
2.
Inclusión de oncológicos con limitación de indicaciones
La inclusión de medicamentos oncológicos con limitación de indicaciones
es contradictoria con el concepto de "actualización integral" del
POS. Si actualizar el POS se entiende como robustecerlo con la inclusión de
nuevas tecnologías para cubrimiento integral de las patologías más
prevalentes, resultan lógicas las inclusiones como las del punto anterior
(gama de biofármacos para completar las opciones terapéuticas de Artritis
Reumatoide). Pero, son contradictorias e ilógicas, las inclusiones tan
restrictivas como las de cuatro (4) Oncológicos que comentamos a
continuación.
2.1. Caso CAPECITABINA
para "USO EN CÁNCER DE MAMA METASTÁSICO RECURRENTE"
Si tomamos en cuenta las indicaciones aprobadas por el INVIMA, encontramos que además de Cáncer de Mama
(no solo metastásico recurrente), la CAPECITABINA (XELODA® de ROCHE) está
indicada:
- COMO TRATAMIENTO DE PRIMERA LÍNEA EN EL CÁNCER COLORRECTAL METASTÁSICO,
- COMO TRATAMIENTO DE PRIMERA LÍNEA EN EL CÁNCER GÁSTRICO AVANZADO,
Entonces, ¿Por qué el Acuerdo 29 de la CRES incluyó solo la indicación
"TRATAMIENTO DEL CÁNCER DE ESTÓMAGO"? y ¿Por qué la Resolución
5521 ratifica esa indicación y amplía solo a "CÁNCER DE MAMA METASTÁSICO RECURRENTE"?.
Si "XELODA ESTÁ INDICADO, ADEMÁS COMO MONOTERAPIA EN EL TRATAMIENTO DEL CÁNCER DE MAMA LOCALMENTE AVANZADO"
-que no es "METASTÁSICO RECURRENTE"- ¿por qué la CAPECITABINA no está
incluida en el POS para esa indicación? ¿por qué tampoco está incluida para "CÁNCER COLORRECTAL METASTÁSICO"?.
2.2. Caso DOCETAXEL para
"CÁNCER DE PRÓSTATA AVANZADO HORMONO-REFRACTARIO"
Es otra de las inclusiones con limitación drástica de indicaciones. Se
incluye solo la indicación de "CÁNCER DE PRÓSTATA AVANZADO HORMONO-REFRACTARIO",
cuando -por ejemplo- en el registro sanitario de TAXOTERE® de SANOFI_AVENTIS
aparecen aprobadas por el INVIMA las siguientes indicaciones:
"TRATAMIENTO DE PACIENTES CON CANCER DE MAMA LOCALMENTE AVANZADO O METASTASICO. TRATAMIENTO DE PACIENTES CON CANCER DE PULMON DE CELULAS NO PEQUEÑAS. TRATAMIENTO DE PACIENTES CON CANCER DE OVARIO. TRATAMIENTO DE PACIENTES CON SARCOMA DE KAPOSI DISEMINADO Y/O VISCERAL ASOCIADO A SIDA, DESPUES DEL FRACASO DE QUIMIOTERAPIA PREVIA. TRATAMIENTO DE PACIENTES CON CARCINOMA DE CELULAS ESCAMOSAS DE CABEZA Y CUELLO,LOCALMENTE AVANZADO, NO RESECABLE (ESTADIO III O IV), CON BUEN ESTADO FUNCIONAL. TRATAMIENTO DE PACIENTES CON CÁNCER DE PRÓSTATA METASTÁTICO ANDRÓGENO INDEPENDIENTE Y COADYUVANTE Y TRATAMIENTO COADYUVANTE EN PACIENTES CON CANCER DE MAMA OPERABLE CON GANGLIOS AUXILIARES POSITIVOS. TAXOTERE EN COMBINACIÓN CON CISPLATINO Y 5-FU PARA EL TRATAMIENTO EN PACIENTES CON ADENOCARCINOMA GÁSTRICO AVANZADO, INCLUYENDO ADENOCARCINOMA DE LA UNIÓN GASTROESOFÁGICA, QUE NO HAN RECIBIDO QUIMIOTERAPIA PREVIA PARA LA ENFERMEDAD AVANZADA. PACIENTES CON CÁNCER DE MAMA OPERABLE CON GANGLIOS NEGATIVOS CON UNO O MÁS FACTORES DE ALTO
RIESGO".
2.3. Caso EPIRUBICINA para
"USO EN TRATAMIENTO DE PACIENTES CON CÁNCER GÁSTRICO RESECABLE"
La Resolución 5521 incluye "EPIRRUBICINA" (en nuestra base de datos
es EPIRUBICINA) solo para la indicación "CÁNCER GÁSTRICO RESECABLE",
cuando en el registro sanitario de FARMORUBICINA® de PFIZER aparecen
aprobadas por el INVIMA también las siguientes indicaciones:
"TRATAMIENTO DE LEUCEMIAS AGUDAS, LINFOMAS MALIGNOS, SARCOMAS DE PARTES BLANDAS, CARCINOMA GASTRICO, CARCINOMA DEL HIGADO, PANCREAS, RECTO SIGMOIDIO, CARCINOMAS CERVIFACIALES, CARCINOMA PULMONAR, CARCINOMA OVARICO"
(con errores ortográficos que también abundan en la base de datos del
INVIMA).
2.4. Caso BEVACIZUMAB para
"USO EN TRATAMIENTO DE PRIMERA Y SEGUNDA LÍNEA DE CÁNCER COLORECTAL"
La Resolución 5521 incluye solo la indicación TRATAMIENTO DE PRIMERA Y SEGUNDA LÍNEA DE CÁNCER COLORECTAL,
cuando en el registro sanitario de AVASTIN® de ROCHE aparecen también
aprobadas por el INVIMA las indicaciones:
"TRATAMIENTO DE PRIMERA LÍNEA DEL CÁNCER RENAL AVANZADO Y/O METASTÁSICO EN COMBINACIÓN CON INTERFERÓN ALFA-2A (INF). ·AVASTIN EN COMBINACIÓN CON QUIMIOTERAPIA BASADA EN PLATINO, EN PRIMERA LÍNEA EN PACIENTES CON CÁNCER DE PULMÓN NO MICROCÍTICO (CPNM), NO ESCAMOSO, IRRESECABLE, LOCALMENTE AVANZADO, METASTÁSICO O RECURRENTE. ·TRATAMIENTO DE GLIOBLASTOMA CON ENFERMEDAD PROGRESIVA POSTERIOR A TERAPIA PREVIA".
La Federación Médica
Colombiana y OBSERVAMED en su condición de peritos expertos voluntarios de la
Sala de Seguimiento de la Sentencia T-760, conceptúan que la actualización
del Plan de Beneficios POS de la Resolución 5521 de
2013, utiliza una metodología de "inclusiones
limitadas por restricciones drásticas de
indicaciones" que es cuestionable y en los hechos genera exclusiones
y "zonas grises" que inducen prácticas
perversas en los recobros al FOSYGA. Por lo tanto, esta Actualización POS
2013 no puede considerarse "integral" y no cumple con el espíritu y
la letra de las órdenes de la Honorable Corte Constitucional en este tema. En
consecuencia, solicitan a la Subdirección de Beneficios en Aseguramiento de la Dirección de Regulación de Beneficios, Costos y Tarifas del Ministerio de Salud y Protección Social,
haga públicos los argumentos científicos y económicos que respaldaron sus decisiones,
en un documento que responda puntualmente las observaciones de fondo y forma
que se plantean en estos informes. El Derecho de Petición y la respuesta se
pondrán en conocimiento de la H. Corte Constitucional, la Defensoría, la
Contraloría General, PGN y demás organismos de control.
Vea en el
próximo Boletín los casos de OCTREOTIDA, SOMATOSTATINA, ESCITALOPRAM, PAROXETINA,
LEVETIRACETAM, OXCARBAZEPINA y TOPIRAMATO.
|