|
1.1.
Citación a la Comisión Intersectorial de Propiedad Intelectual
El Artículo
7° del Decreto 1162 de 2010 (AR)
dice textualmente: "Reuniones. La CIPI
sesionará ordinariamente una vez al año previa convocatoria
de la Secretaría Técnica, y de manera extraordinaria, cuando
así sea convocada por la Secretaría Técnica por
requerimiento de al menos dos de sus miembros con voz y
voto".
En
el acta
de la reunión mencionada no se especifica cuáles fueron los "miembros
con voz y voto" que hicieron el requerimiento de Ley, ni las razones que
adujeron para esta convocatoria extraordinaria. Es importante que la
ciudadanía conozca quienes fueron (ver Derecho de petición a la
CIPI).
Los
conceptos emitidos en dicha reunión fueron demasiado favorables a los
intereses comerciales de Novartis, lo que permite suponer que puede existir
una coincidencia en la intencionalidad de la citación a reunión
extraordinaria de la CIPI con las gestiones de AFIDRO (gremio de farmacéuticas
multinacionales) y los conceptos emitidos en dicha reunión (click aquí o en gráfico N°1 para ver
la carta de AFIDRO).
1.2.
Acta de reunión de la CIPI muestra conceptos sesgados a favor de Novartis
De la lectura del Acta se desprende que las intervenciones de los
representantes de la Superintendencia de Industria y Comercio,
liderados por José
Luis Londoño Fernández Superintendente Delegado para la
Propiedad Industrial -ya sea en forma de solicitudes de
aclaración o pedidos de solidez técnica- se orientaron a
imponer los conceptos que finalmente fueron incorporados
como un anexo del Acta.
El
documento
de la SIC contiene afirmaciones sobre la declaratoria de interés público y
sobre la licencia obligatoria que se oponen radicalmente a la posición
adoptada por el Ministerio de salud en este proceso tal como queda demostrado
en el siguiente punto.
2.
Consideraciones técnicas sobre conceptos emitidos por funcionarios de la SIC
Dada la importancia del tema,
considero útil extenderme en los siguientes detalles técnicos.
2.1. No es verdad que exista un vacío normativo nacional e internacional
El
punto 1 del anexo de la SIC (ver
Acta AR)
comienza afirmando: "La Constitución Política de Colombia no cuenta con
una definición del concepto de 'interés público'. Lo propio ocurre con la
Decisión 486 de 2000 y dentro del texto de los ADPIC. El 'interés público'
resulta ser de aquellos conceptos denominados como indeterminados, que no
encuentran una definición concreta en el ordenamiento y tampoco pueden ser
descritos de una manera general". Es decir, el "interés público"
está indeterminado y debe ser "interpretado".
|
Respuesta
2.1.
El concepto de los funcionarios de la SIC puede ser verosímil, pero
no es verdadero, porque:
A nivel nacional la
Ley
1751 de 2015 llamada Estatutaria de
Salud (por su rango superior) es taxativa cuando en el Artículo 5°
relativo a Obligaciones del
Estado, en el inciso j) ordena: “Intervenir el mercado de
medicamentos, dispositivos médicos e insumos en salud con el fin de
optimizar su utilización, evitar las inequidades en el acceso,
asegurar la calidad de los mismos o en general cuando pueda derivarse
una grave afectación de la prestación del servicio”. Y en el Artículo
23. Política Farmacéutica
Nacional, dice: Parágrafo. “El Gobierno Nacional, por
intermedio del Ministerio de Salud y Protección Social, estará a
cargo de regular los precios de los medicamentos a nivel nacional".
A nivel internacional, una
visita elemental a la página
de la OMC, muestra que, en respuesta a la pregunta ¿Es
necesario que se trate de un caso de emergencia? dice: "Se
trata de un malentendido muy corriente" y a continuación
aclara: "El Acuerdo sobre los ADPIC no enumera específicamente
las razones que podrían invocarse para justificar las licencias
obligatorias. Sin embargo, la Declaración
Ministerial de Doha sobre los ADPIC y la Salud Pública confirma
que los países tienen libertad para determinar los motivos para la
concesión de licencias obligatorias".
Este
concepto está ahora respaldado por la carta que 132
expertos, varios de prestigio mundial, enviaron al Presidente de
la República y la carta que la Dirección
General de Sistemas de Salud e Innovación de la OMS envió al
Ministerio de Salud.
Por
lo tanto, el vacío normativo que justificaría las
"interpretaciones" de los funcionarios de la SIC, no existe.
Es decir, dichos funcionarios debieron abstenerse de emitir sus
"interpretaciones" porque, ni según la Ley Estatutaria
de Salud, ni según la OMC y la OMS, Colombia necesita estar en
"estado de guerra exterior o estado de conmoción interior"
para tener la libertad de declarar razones de interés público con
fines de licencia obligatoria de un medicamento que se niegue a
negociar un precio razonable y pretenda incurrir en prácticas de
abuso de posición dominante. |
2.2. No son necesarias las disquisiciones entre interés público permanente y transitorio
Luego de identificar dos escenarios de nuestra Constitución Política,
el documento de la SIC define interés público como interés del Estado en
que exista acceso a la salud y le llama “interés público de carácter
permanente e inmutable".
Diferencia
lo anterior de "otros escenarios constitucionales" de "interés
público transitorio" "como es el caso de los estados de excepción
como el Estado de Guerra Exterior, el Estado de Conmoción Interior y el
Estado de Emergencia, los cuales pueden ser decretados por el Presidente de la
República y que se encuentran consagrados en los artículos 212 a 215 de la
Constitución Política".
Y
afirma más adelante "debe concluirse que el interés público del que
trata el artículo 65 de la Decisión 486 de 2000 es un interés público de
carácter temporal y que no debe ser confundido con el interés público
permanente que rodea el actuar de la administración". Según esta
interpretación, como Colombia no se encuentra en estado de emergencia,
conmoción interior o guerra exterior -es decir, no existe "interés público
transitorio"- la declaratoria de "interés público permanente o
inmutable" que propone el Ministerio de Salud no respetaría ni la
constitución ni la normatividad internacional.
Respuesta
2.2.
Estas disquisiciones de los funcionarios de la SIC son innecesarias
porque –como ya se dijo en el punto 2.1.- existen normas de rango
superior perfectamente aplicables. Según
la
Ley Estatutaria de Salud, y según la OMC y la OMS, Colombia NO
necesita estar en "estado de guerra exterior o estado de conmoción
interior" para tener la libertad de declarar razones de interés
público con fines de licencia obligatoria de un medicamento que se
niegue a negociar un precio razonable y pretenda incurrir en prácticas
de abuso de posición dominante. |
2.3. En este caso no aplica la obligación de indemnización por expropiación
Las disquisiciones de los
funcionarios de la SIC concluyen así: "en
el presente caso el interés público se fundamenta en la sostenibilidad de
las finanzas públicas. Es en este escenario donde surge precisamente la
obligación de indemnización por expropiación. Así las cosas, el
ahorro que pudiera surgir para el Estado de las consecuencias de la
declaratoria de la licencia obligatoria en relación con el precio del
medicamento determinado, estaría debilitado por la indemnización que tendría
que otorgar al titular del derecho de exclusiva". Además, la
medida "iría en contravía del deber constitucional del Estado de promover las
actividades de ciencia y tecnología, de otorgar incentivos para su promoción
y de proteger la propiedad intelectual". Luego "si
la existencia de una licencia obligatoria se condiciona al precio, en el mismo
momento en que el titular de la patente disminuya el precio de venta del
medicamento protegido por patente, no habría razón alguna para la concesión
de licencias obligatorias". Y además "la
obtención de una licencia obligatoria por parte de terceros no resultaría
atractiva para estos" porque "los costos en los que podrían
incurrir los posibles laboratorios licenciatarios tanto en la producción del
medicamento como en las autorizaciones sanitarias correspondientes, no harían
llamativa la obtención de una licencia obligatoria, máxime si la protección
de la patente está próxima a concluir en el tiempo, como ocurre en el
presente caso donde la patente sobre la que se concedería una licencia
obligatoria vence el 09 de julio de 2018".
En
resumen, según las interpretaciones erróneas y sesgadas de funcionarios de
la SIC, la declaratoria de interés público
propuesta por el Ministerio de Salud, no tiene suficiente solidez técnica, es
inconstitucional, resulta inútil en la práctica y expone al país a
sanciones, por violar normas internacionales sobre propiedad intelectual.
|
Respuesta 2.3.
Los funcionarios de la SIC, liderados por el Superintendente Delegado
para la Propiedad Industrial, José Luis Londoño Fernández, incurren
aquí, en contradicción misional y errores conceptuales.
La
contradicción misional consiste en que, siendo función
fundamental de todo servidor público, los funcionarios de la SIC
estaban en la obligación de defender el interés de la nación y
respetar la constitución y el espíritu y la letra de las leyes
vigentes. Pero, la lectura del anexo
de la SIC, muestra que -violando este principio de lealtad con la
función pública- los funcionarios de la SIC, incurren en
"interpretaciones" erróneas y sesgadas a favor de Novartis,
que más parecen elaboradas por abogados de la multinacional suiza,
antes que por funcionarios de un organismo estatal colombiano.
Los
errores conceptuales se mostraron en los puntos 2.1. a 2.3. y
además se detallan a continuación, en el punto 3 y siguientes. |
3.
Inconsistencias técnicas incluidas en el anexo de los funcionarios de la SIC
El
anexo
de los funcionarios de la SIC contiene una serie de inconsistencias que
pasamos a evidenciar:
3.1. Versión parcial y sesgada sobre la historia de la patente del "cristal beta" en Colombia
Sobre la historia de la patente del "cristal beta" de Imatinib
en Colombia, el anexo
dice:
"La solicitud de patente fue presentada en Colombia el 09 de julio de
1998 al reivindicar el derecho de prioridad de la solicitud suiza identificada
con el número CH1764/97, por lo que se encuentra vigente hasta el 09 de julio
de 2018”.
“Es
importante señalar que en el estado de la técnica relacionado con el estudio
de formas polimórficas de IMATINIB se reportan los cristales H1, α,
α2, δ, ε, I, II, F, G, H, I y K, divulgados en diferentes
documentos de patente, tal es el caso de WO2005077933, WO2005095379,
WO2004106326, WO2006054314, WO2006024863, WO2006048890, US20060030568 y
WO2007023182 que no fueron presentados en Colombia.
Y en el caso de otras formas de sal de IMATINIB reivindicadas en la solicitud
06-76505 y de los estados amorfos de mesilato de imatinib reivindicados en la
solicitud 09-139945, la Superintendencia de Industria y Comercio decidió
negar el privilegio de patente" (resaltados corresponden al original).
|
Respuesta 3.1.
El anexo
de los funcionarios de la SIC muestra una historia de la patente del
"cristal beta" de Imatinib en Colombia, que no corresponde a
la realidad. Tras sus datos técnicos existe un error conceptual ligado a que ignoran los siguientes hechos:
- La sociedad
NOVARTIS AG, en acción de nulidad y restablecimiento del derecho,
consagrada en el artículo 85 del C.C.A., presentó demanda ante el
consejo de estado tendiente a obtener la nulidad de la Resolución núm.
04164 de 26 de febrero de 2003, mediante la cual se negó la concesión
de la patente de invención denominada "MODIFICACIÓN DE CRISTAL
DE UN DERIVADO DE N-FENIL-2-PIRIMIDINA PROCESOS PARA SU FABRICACIÓN Y
USO".
- El Consejo de
Estado en Sentencia
a favor del demandante, dijo:
Primero: DECLÁRASE la nulidad de las Resoluciones núms. 04164 de 25
de febrero de 2003 y 16268 de 16 de junio de 2003, proferidas por el
Superintendente de Industria y Comercio.
Segundo: En consecuencia y a título de restablecimiento del derecho,
ORDÉNASE a la Superintendencia de Industria y Comercio conceder la
patente de invención a las reivindicaciones 1 a 13 de la solicitud de
patente de invención "MODIFICACIÓN DE CRISTAL DE UN DERIVADO DE
N-FENIL -2-PIRIMIDINAMINA, PROCESOS PARA SU FABRICACIÓN Y USO".
-
La Sentencia
-inmediatamente antes del fallo, pág.42- dice: "Las
pruebas aportadas al proceso, como ya se advirtió, no fueron
controvertidas ni desvirtuadas por la Superintendencia de Industria y
Comercio en las oportunidades pertinentes, amén de que no contestó
la demanda". Sobre los conceptos de los peritos en que
se basó para otorgar la patente, el fallo del Consejo de Estado dice:
“la Superintendencia de
Industria y Comercio no objetó ni su idoneidad ni sus conceptos".
Estos
peritos presentados por Novartis fueron Bertrand Sutter co-inventor de
Imatinib (ver InfoPat-Mex
patente MX 218673 y pag.24-27 del fallo)
y José Antonio Henao Martínez (p.28-31) Doctor en estudio de
materiales, cuyo CvLAC
mostraba más estudios de química general que temas de la industria
farmacéutica.
Por
lo tanto, la verdadera historia no corresponde a la visión de estos
funcionarios, donde la SIC conoce patentes que no fueron presentadas
en Colombia, otorgó la patente sobre el cristal beta y negó las
patentes sobre otras sales y los estados amorfos del Mesilato de
Imatinib. La verdadera historia dice que la patente de invención
"MODIFICACIÓN DE CRISTAL DE UN DERIVADO DE N-FENIL
-2-PIRIMIDINAMINA, PROCESOS PARA SU FABRICACIÓN Y USO" fue
inicialmente negada por la SIC por “falta de altura inventiva” y
después otorgada por orden del Consejo de Estado, luego de un proceso
donde existió evidente irresponsabilidad
de funcionarios de la SIC que no contestaron la demanda, no
controvirtieron ni desvirtuaron los argumentos de Novartis y tampoco
objetaron ni la idoneidad ni los conceptos de sus peritos. |
3.2. Visión errónea sobre la gama de productos disponibles con IMATINIB
El punto 2 del anexo
(AR)
de los funcionarios de la SIC, continúa con un detallado análisis de
registros sanitarios disponibles en Colombia que contienen distintas formas de
Mesilado de Imatinib, con el evidente propósito de mostrar que existe tal
disponibilidad de medicamentos con Imatinib, que invalidaría el argumento de
"apertura a la competencia" que propone el Ministerio de Salud.
|
Respuesta
3.2.
La gama de registros sanitarios con IMATINIB no equivale a
disponibilidad real de productos.
El error
conceptual en este caso, está en que los funcionarios de la SIC
confunden "disponibilidad de registros sanitarios" con
"disponibilidad real de productos" y suponen que una mirada
a los archivos de registros sanitarios puede comprarse con los
estudios de competencia e impacto sobre la sostenibilidad del sistema
de salud que pueden verse -por ejemplo- en el
Informe
del comité técnico para la declaratoria de interés público del
Ministerio de Salud.
El Gráfico N°2 del anexo
de la SIC, muestra relaciones de competencia que solo existen en el
escritorio del funcionario que elaboró el informe. Las
relaciones de competencia en el mundo real son muy distintas, tal como
puede verse en el siguiente análisis del gráfico de la SIC:
Gráfico N°2: Formas disponibles de Mesilato de Imatinib en Colombia
según la SIC
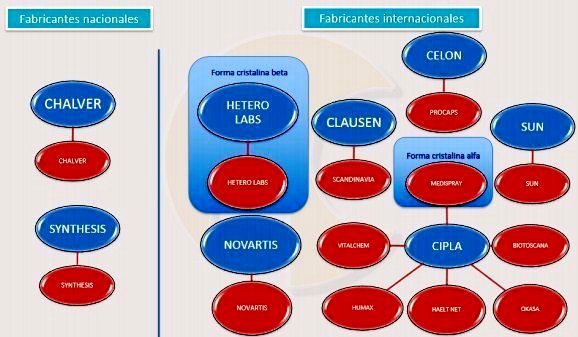
El gráfico 2 muestra
con fabricación nacional a LEUSOMIN de CHALVER y ZEITE de
SYNTHESIS. LEUSOMIN tiene registro sanitario desde 2012, pero el
laboratorio no reportó ninguna venta a SISMED, es decir, no
está disponible.
- Con fabricación internacional, destaca IMATERO de HETERO
LABS (registrado en 2014 y sin ventas reportadas a Sismed). Es la
forma patentada no podrá comercializarse.
- Por fuera del recuadro de la forma cristalina beta aparece GLIVEC de
NOVARTIS que no especificó si contiene dicha forma -cristalina beta-
en sus registros sanitarios.
Entre las opciones ligadas a la forma cristalina alfa, llama la atención
el caso LEUTINIB comercializado xVITALCHEM. De 2012 a 2014, LEUTINIB
fue el competidor que reportó el mayor número de unidades vendidas,
razón por la cual Novartis le sometió a presiones legales (ver
anexo#2) hasta prácticamente sacarlo del mercado en 2015.
MATIB de HUMAX (también de CIPLA) ya no reportó ventas en 2015.
IMATINIB de HEALT NET y COMERCIAL MEDICA también CIPLA (genéricos) salieron
del mercado el 2012. ZOLTEC de LEGRAND-CIPLA tiene registro
sanitario desde 2010 y no tiene ventas reportadas a SISMED. El 2015,
BIOTINIB de BIOTOSCANA-CIPLA prácticamente salió del mercado. Solo
quedan LEMATIN de LAFRANCOL-ABBOT de SUN, MATINAC de
SCANDINAVIA-CLAUSEN e IMATIN de PROCAPS-CELON que vendió
solo 37 unidades en 2015. |
3.3. Visión sesgada de los funcionarios de la SIC sobre uso de inhibidores de tirosina quinasa
Como ya se dijo antes, en su propósito de
demostrar que existen alternativas terapéuticas que invalidan los argumentos
del Ministerio de Salud, los funcionarios de la SIC pasan al campo clínico y
se atreven a decir: "En la misma
vía de alternativas farmacoterapéuticas para el manejo de la leucemia
mieloide crónica, es del caso señalar que los inhibidores de tirosina
quinasa que inhiben la proteína BCR-ABL, causante de las señales de
proliferación anormales, como Dasatinib y Nilotinib son alternativas
farmacoterapéuticas a las que la autoridad sanitaria ha otorgado registro con
la indicación antes mencionada. Concretamente, en el caso del monohidrato de
dasatinib se encuentran alrededor de diez registros sanitarios vigentes
conferidos a Laboratorios Synthesis y a Bristol Myers Squibb de Colombia S.A.
Asimismo, en el caso de nilotinib se encuentran dos registros sanitarios para
el clorhidrato monohidrato de nilotinib otorgados a Novartis Pharma A.G."
|
Respuesta
3.3.
Otro error conceptual de los funcionarios de la SIC liderados
por Londoño Fernández, tiene que ver con su concepto erróneo y
sesgado de "alternativas farmacoterapéuticas para el manejo de
la leucemia mieloide crónica". Obviamente, desconocen que otros
inhibidores de tirosina quinasa son más costosos y están
indicados en casos de resistencia o intolerancia a Imatinib, es
decir, los funcionarios de la SIC desconocen los siguientes hechos:
Los principales
"NIBs" indicados en el tratamiento de casos típicos y
refractarios de Leucemia Mieloide Crónica -IMATINIB, NILOTINIB y
DASATINIB- tienen precio regulado en Colombia, y los gráficos N°3 y
N°4 muestran dicho precio por miligramo y por tratamiento día. Los
precios que se muestran corresponden a los Precios Máximos de Venta
PMV de la regulación basada en Precios Internacionales de Referencia
PRI (Circulares 04, 05, 06 y 07 de 2013) con los incrementos de la
Circular 01 de 2014 (3,5% para precios mayores de COP 1.000.000) y de
la Resolución 0718 de 2015. El PMV con estos ajustes se denomina Precio
Regulado Actual o Ajustado PRA, en el Sistema VMI-CFN.
Gráfico
N°3: Precio Regulado Actual por miligramo 3 NIBs - Abril 2016
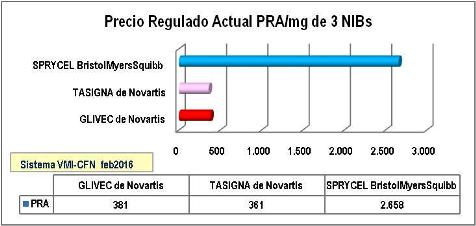
Gráfico
N°4: Precio Regulado PRA x tratamiento/día 3 NIBs - Abril 2016
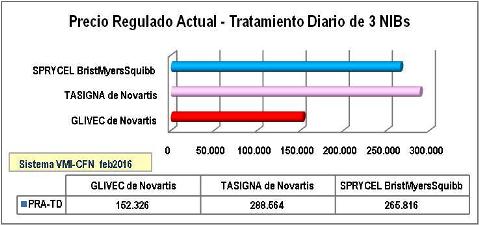
Nótese que las
diferencias de precios por miligramo se modifican sustancialmente al
convertirse en dosis diarias correspondientes a 400 mg de IMATINIB (1
comprimido de 400 mg o 4 comprimidos de 100 mg al día), 800 mg de
NILOTINIB (2 cápsulas de 200 mg, 2 veces al día) y 100 mg de
DASATINIB (con ajustes en tabletas recubiertas de 20, 50, 70, 100, 140
mg). Nótese también que el
precio de la dosis diaria de NILOTINIB (Tasigna® de Novartis) es el más
elevado y casi duplica a IMATINIB (Glivec® de Novartis) y el
precio de la dosis diaria de DASATINIB (Sprycel® de
BristolMyersSquibb) es casi tan elevado como NILOTINIB de Novartis.
En consecuencia, tanto NILOTINIB como DASATINIB pueden
considerarse "alternativas farmacoterapéuticas"
costoeficientes SOLO EN CASOS DE RESISTENCIA O INTOLERNCIA A
IMATINIB, cuando se justifica su uso, pese a sus costos más elevados.
Adicionalmente, el
registro sanitario de TASIGNA® (NILOTINIB de Novartis) dice:
Indicaciones TRATAMIENTO DE LA FASE CRÓNICA Y ACELERADA DE LA
LEUCEMIA MIELOIDE CRÓNICA ASOCIADA AL CROMOSOMA FILADELFIA (PH
POSITIVO), EN PACIENTES ADULTOS CON RESISTENCIA O INTOLERANCIA A
POR LO MENOS UN TRATAMIENTO PREVIO QUE INCLUYA IMATINIB.
Y
el registro sanitario de diferentes concentraciones de SPRYCEL®
(DASATINIB de BristoMyersSquibb) dice: ESTÁ INDICADO PARA EL
TRATAMIENTO DE ADULTOS CON: . LEUCEMIA MIELOIDE CRÓNICA (LMC) CON
CROMOSOMA PHILADELPHIA POSITIVO (PH+) EN FASE CRÓNICA DE DIAGNÓSTICO
RECIENTE. . LMC PH+ EN FASE CRÓNICA, ACELERADA, O MIELOBLÁSTICA O
LINFOBLÁSTICA CON RESISTENCIA O INTOLERANCIA A TRATAMIENTO PREVIO,
INCLUIDO IMATINIB. . LEUCEMIA LINFOBLÁSTICA AGUDA CON CROMOSOMA
PHILADELFIA POSITIVO (LLA PH+) CON RESISTENCIA O INTOLERANCIA A
TRATAMIENTO PREVIO. |
Por
lo aquí expuesto, los conceptos de los funcionarios de la SIC sobre la
patente de Imatinib y su historia, la gama de productos supuestamente
competidores y la también supuesta existencia de alternativas farmacoterapéuticas
con inhibidores de tirosina quinasa,
-
Son inconsistentes, porque se basan en datos errados e incompletos y
-
Están sesgados, porque no buscan defender el interés de la nación y
favorecen el interés comercial de Novartis, otorgándole argumentos para
que se niegue a negociar un precio razonable y pueda incurrir en prácticas de
abuso de posición dominante.
| Continuación
Derecho de Petición a CGR:
Resulta
claro que, la actitud de los funcionarios que ya
expresaron públicamente su apoyo a las pretensiones
comerciales de Novartis y demostraron su escaso interés
en la defensa del interés público, generará un
deterioro patrimonial de COP 80.000 millones
adicionales a los COP 80.000 millones ya
causados en 2012-15 por otorgamiento de la patente
irregular al cristal beta de Imatinib (ver punto N°4)
4.
Estimación daño patrimonial del Estado Colombiano con Imatinib por gestión de la SIC
Dado que es función de
la Contraloría General de la República,
“establecer la responsabilidad fiscal de los
servidores públicos y de los particulares que causen,
por acción o por omisión y en forma dolosa o
culposa, un daño al patrimonio del Estado”, ponemos
en su conocimiento las siguientes estimaciones de
posible deterioro fiscal causado por funcionarios de
la SIC:
4.1.
Daño fiscal por otorgamiento patente al cristal beta de Imatinib por negligencia de la SIC
Asumiendo que la propuesta del Ministerio de Salud
(Precio Máximo de Venta PMV=COP 140/mg) para GLIVEC
es técnicamente válido en un escenario de
“competencia simulada”, es posible estimar el daño
patrimonial generado por la negligencia de los
funcionarios de la SIC que al no responder la demanda
de Novartis permitieron que la patente otorgada al
“cristal beta” de Imatinib (Glivec) elimine la
competencia.
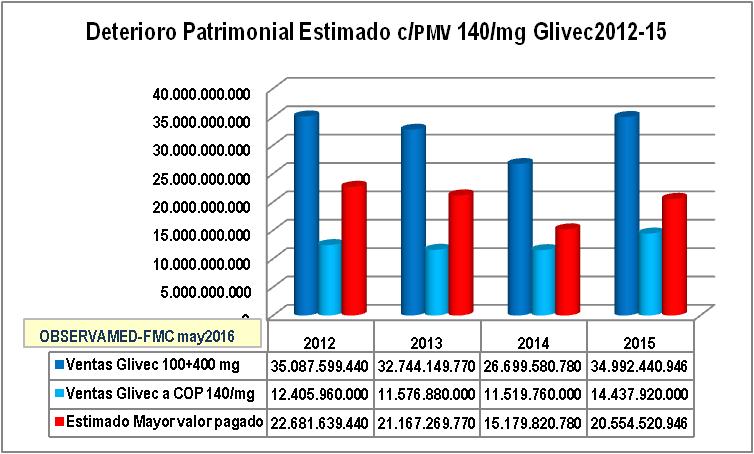
El gráfico N°5 muestra
una comparación de las ventas reportadas a SISMED
2012 a 2015 de Glivec 100 mg + 400 mg (columnas azul
oscuro) comparadas con el valor de las unidades
vendidas de 100 mg y 400 mg en miligramos a un valor
PMV de COP 140/mg (columnas azul claro). La diferencia
constituye el mayor valor pagado por la nación cada año
(columnas rojas) que solo en los años 2012 a 2015
muestra un acumulado de COP 79.583.250.936.-
Aunque
existen otras formas de calcular este daño
patrimonial, la basada en PMV 140/mg es más oficial.
4.2.
Daño fiscal por interferencia al otorgamiento de licencia obligatoria de Imatinib en la SIC
Si
tomamos como referencia el daño patrimonial del año
2015 (COP 20.000
millones) y estimamos que las variables se
compensarán con resultados similares hasta julio del
2018 (vencimiento de la patente) y se prolongarán por
un "período
de transición o inercia" -propio de este
mercado- durante año y medio post vencimiento de la
patente, hasta finales del año 2019 se acumulará un
daño patrimonial de COP 80.000
millones (según el estimado más conservador,
pero algo más oficial). De esta forma, el daño
acumulado por acciones u omisiones, dolosas o culposas
de los funcionarios de la SIC alcanzará por lo menos
los COP 160.000
millones. |
Continuación
Derecho de Petición a PGN:
Resulta
claro que, funcionarios que ya expresaron públicamente su apoyo a las
pretenciones comerciales de Novartis y demostraron su escaso interés en la
defensa del interés público, deben marginarse de este proceso porque no
ofrecen ninguna garantía de justicia y probidad.
PETICION
Por
lo expuesto, en ejercicio de
los derechos constitucionales y legales de petición de información, de
acceso a documentos públicos, y de acceso a la administración de justicia
(C. P. de C. Arts. 23, 20, 74, 229; D.L. 01 de 1984, Arts. 9º y ss., 17º y
ss.; Ley 57 de 1985, Arts. 12º y ss.), de manera respetuosa, presenta
ante su autoridad la petición de iniciar
investigación administrativa de las acciones u omisiones, dolosas o
culposas, en que hubiesen incurrido los funcionarios de la Superintendencia de
Industria y Comercio durante el proceso de declaratoria de interés público
de IMATINIB con fines de licencia obligatoria.
OBJETO DE LA PETICION
Dentro
del objeto misión de la Federación Médica Colombiana -entidad del orden
nacional que agrupa a los Colegios Médicos Departamentales, que por diversas
leyes de la República es consultora y asesora del Gobierno Nacional en los
temas atinentes a la ética y salud- se encuentra la defensa de los intereses
de la salud pública.
Ahora que –en caso de que
el Ministro de Salud firme la declaratoria de interés público de IMATINIB- y
el proceso de licencia obligatoria pase a la SIC, los funcionarios de esa
entidad que emitieron conceptos erróneos favorables a los intereses
comerciales de Novartis, deben saber que los actos contrarios al interés de
la nación no quedan en la impunidad.
NOTIFICACIONES
Recibiremos
contestación en la Carrera 7 No. 82-66. Oficinas 218 y 219, teléfono 8050073
de Bogotá DC
Atentamente,
Dr.
Sergio Robledo Riaga
C.C. N° 19.480.671
Veedor
VCACELAPSS
Vicepresidente Asuntos Financieros
FEDERACION MEDICA COLOMBIANA
|
Gráfico N°5: Deterioro
Patrimonial Estimado con Glivec 2012 a 2015 con PMV 140/mg ofrecido por
MinSalud a Novartis
PETICION
Por
lo expuesto, en
ejercicio de los derechos constitucionales y legales de petición
de información, de acceso a documentos públicos, y de acceso
a la administración de justicia (C. P. de C. Arts. 23, 20,
74, 229; D.L. 01 de 1984, Arts. 9º y ss., 17º y ss.; Ley 57
de 1985, Arts. 12º y ss.), de manera respetuosa, presenta
ante su autoridad la petición de estudiar la posibilidad de expedir una función de advertencia por el posible daño patrimonial
generado por las acciones u omisiones, dolosas o culposas, en
que hubiesen incurrido los funcionarios de la Superintendencia
de Industria y Comercio durante el proceso de otorgamiento de
patente, declaratoria de interés público y trámite de
licencia obligatoria de IMATINIB.
OBJETO DE LA
PETICION
Dentro
del objeto misión de la Federación Médica Colombiana
-entidad del orden nacional que agrupa a los Colegios Médicos
Departamentales, que por diversas leyes de la República es
consultora y asesora del Gobierno Nacional en los temas
atinentes a la ética y salud- se encuentra la defensa de los
intereses de la salud pública y es función primordial de la
CGR “vincular activamente a la ciudadanía en el control de
la gestión pública”.
NOTIFICACIONES
Recibiré
contestación en la Carrera 7 No. 82-66. Oficinas 218 y 219,
teléfono 8050073 de Bogotá DC
Atentamente,
Dr.
Sergio Robledo Riaga
C.C. N° 19.480.671
Veedor VCACELAPSS
Vicepresidente Asuntos Financieros
FEDERACION MEDICA COLOMBIANA
Envíe sus aportes y
comentarios a observamed.fmc@gmail.com
o trine con @OBSERVAMED
Sobre
conflictos de interés:
La iniciativa "Elijamos
Sabiamente" de la Federación
Médica Colombiana FMC y el Colegio
Nacional de Químicos Farmacéuticos de Colombia CNQFC, no recibe ninguna retribución monetaria, ni en
especie, de ninguna entidad pública ni privada, que pueda comprometer
la independencia de sus investigaciones e informes.
|