-
Los
Anticuerpos monoclonales, que reportaron
ventas por COP 1.469.926 millones en los 4 años, con un
sobreprecio estimado de COP 334.138 millones en 8 a 12
medicamentos.
-
Dentro
el anterior grupo, tres productos de Roche, Rituximab (Mabthera®),
Trastuzumab (Herceptín®) y Bevacizumab (Avastín®) que
reportaron ventas por COP 722.633 millones en los 4 años, con un
sobreprecio estimado en COP 235.491 millones.
-
Las
Enzimas recombinantes,
que reportaron ventas por COP 595.540 millones en los 4 años con
un sobreprecios estimado de COP 227.415 millones en 6 a 11
medicamentos.
-
Las
Citocinas, que reportaron ventas por COP
355.612 millones en los 4 años, con un sobreprecio estimado de
COP 93.501 millones en 3 a 5 medicamentos.
Al
analizar la evolución anual del estimado de sobrecostos en los
Anticuerpos monoclonales se aprecia que tuvieron un crecimiento de
COP 78.658 millones el 2008, a COP 100.640 millones el 2009 y COP
116.697 millones el
2010 para luego reducirse a COP 38.144 millones el 2011. (Total COP
334.138 millones).
Tres
Anticuerpos monoclonales de Roche, Rituximab (Mabthera®),
Trastuzumab (Herceptín®) y Bevacizumab (Avastín®) tuvieron
un crecimiento en el estimado de sobrecostos de COP 52.393
millones el 2008, a 76.692 millones el 2009 y 82.840 millones
el 2010, para luego bajar a 23.566 millones el 2011. (Total
COP 235.491 millones).
Las
Enzimas recombinantes de este estudio tuvieron un crecimiento en
el estimado de sobrecostos de COP 40.664 millones el 2008 a COP
51.579 millones el 2001, COP 53.300 millones el 2010 y COP 81.872
millones, es decir, se trata del único grupo en el que no se
reducen los sobrecostos el año 2011. (Total COP
227.415 millones).
Las
Citocinas tuvieron un crecimiento en el estimado de sobrecostos de
COP 21.906 millones el 2008, a COP 30.617 millones el 2009 y COP
32.326 millones el 2010, para bajar hasta COP 9.859 millones el
2011. (Total COP 93.501 millones).
Por
lo tanto, es notoria la reducción de sobrecostos del año 2011,
con excepción del grupo Enzimas recombinantes, que tiene una
evolución contraria, básicamente por influencia del Factor VIIa
Recombinante (Novoseven®) y el Factor VIII Complejo Coagulante
Anti-Inhibidor (Feiba) que tuvieron las mayores ventas acumuladas
(COP 140.097 millones y COP 141.327 millones) y los mayores
sobreprecios acumulados del subgrupo Antihemofílicos (COP 95.227
millones y 85.194 millones, respectivamente). Nótese que al
Factor VIIa Recombinante (Novoseven®) se le asignó un Valor Máximo
de Recobro (VMR) muy superior a los precios internacionales y que
el Factor VIII Complejo Coagulante Anti-Inhibidor (Feiba) no tiene
asignado Valor Máximo de Recobro (VMR).
Figura
2. Efecto Valores Máximos de Recobro (VMR) 2010-2011

La
Figura N°2 muestra que, después de las Resoluciones 05, 1020,
3026, 3470 y 4316 de 2011,
el estimado de sobrecostos de una muestra de 48 biotecnológicos
-que creció de 143.931 millones el 2008 a COP 186.523 millones el
2009 y 213.800 millones el 2010- el año 2011 se redujo a COP
137.492 millones.
Al
relacionar estos datos con la evolución de las unidades vendidas
(ver tablas) puede concluirse que, la fijación de Valores
Máximos de Recobro detuvo -efectiva y realmente- el crecimiento
de sobrecostos.
Pero,
esta solución es aún parcial e insuficiente, porque –como
pasa con los biotecnológicos de mayor impacto no incluidos en el
POS- los Valores Máximos de Recobro siguen siendo superiores a
los precios internacionales y porque, a varios de ellos, no se les
ha definido aún un VMR.
Por
lo tanto, la nueva Política Farmacéutica Nacional y el nuevo régimen
de regulación de precios que prepara el actual gobierno, deben
perfeccionar este y otros mecanismos que permitan –como mínimo-
el respeto de los precios internacionales y en lo posible el
desarrollo de condiciones objetivas que multipliquen los casos en
que estos medicamentos tienen precios más favorables en Colombia.
Sobre
el uso de importaciones paralelas como flexibilidad estipulada en
el Acuerdo sobre Aspectos de los Derechos de Propiedad Intelectual
(ADPIC) puede decirse que la simple amenaza de su aplicación
produjo algunos resultados iniciales (Acuerdo Roche), pero se
desconocen los alcances reales de su aplicación en Colombia. Este
estudio no pudo medir su efecto real, porque se basa en reportes
de los laboratorios y las importaciones paralelas no son
detectables por esa vía.
Sobre
el uso de otras flexibilidades estipuladas en el Acuerdo sobre Aspectos
de los Derechos de Propiedad
Intelectual (ADPIC) -como las licencias obligatorias, que
algunos países aplican con éxito- puede decirse que hasta la
fecha su aplicación no fue posible en Colombia.
La
única experiencia en este campo, fue la iniciativa de la Mesa de
Organizaciones que trabajan en VIH/SIDA, la Red Colombiana de
Personas que viven con VIH, así como las fundaciones IFARMA y
Misión Salud que a mediados del 2008 presentaron una petición
oficial ante la Presidencia de la República, el Ministerio de la
Protección Social y la Superintendencia de Industria y Comercio
para que se expida una Licencia Obligatoria Abierta para el
medicamento Lopinavir-Ritonavir (Kaletra) por motivos de Interés
Público.
La petición fue denegada y estas organizaciones de la sociedad
civil adelantaron una Acción Popular que acaba de ser fallada
(29/febrero/2012) por el Tribunal 37 Civil del Circuito de Bogotá.
La sentencia –parcialmente favorable a la petición- fue apelada
por ambas partes y sigue su curso legal. Mencionamos este caso en
este informe, porque se trata de un caso inédito, donde
organizaciones de la sociedad civil avanzan por el camino de
defensa de la salud pública, que debiera ser recorrido por el
propio gobierno.
Sin
embargo, otras organizaciones de pacientes, adoptaron una actitud
diferente ante una iniciativa del actual gobierno que busca
expedir la normatividad para el registro de biofármacos en
Colombia. El gobierno no ocultó su propósito de abrir la
competencia en ese mercado, pero, algunas asociaciones de
pacientes adoptaron una posición coincidente con AFIDRO
(la agremiación de las multinacionales propietarias de biotecnológicos
monopólicos en Colombia), cuyos voceros no dudaron en afirmar que
Colombia se convertiría en el “paraíso de medicamentos de mala
calidad”
Sin
duda, las posibilidades de apertura del mercado de Biotecnológicos
por la vía de flexibilidades de los mecanismos de protección de
la propiedad intelectual, son mínimas, porque en este campo, se
patentan también los procesos de fabricación. Sin embargo, la
protección de datos de prueba es un mecanismo donde algo puede
hacerse todavía en Colombia, donde el Decreto 2085 extiende dicha
protección por 5 años, mientras la administración Obama ya
aceptó los 12 años. A la fecha, la posibilidad de usar la
clausula sobre “esfuerzo considerable” que está contemplada
en la norma colombiana y cuya intención es premiar la inversión
realizada en el desarrollo de la tecnología, no ha sido utilizada
adecuadamente y de 122 solicitudes de protección de datos se han
otorgado el 81%.
La generosidad en otorgar protección de datos de prueba (que
equivale a otorgar una patente express) está retrasando el
ingreso de competencia al mercado de biotecnológicos y amenaza
sensiblemente las finanzas del sistema de salud.
En
todo caso, la apertura de este mercado a medicamentos
“biosimilares” es un tema que sigue debatiendo en Colombia,
pese a que el informe anual al Representante Comercial de los
Estados Unidos en relación con el artículo especial 301 de la
Ley de Comercio de ese país (Pharmaceutical
Research and Manufacturers of America (PhRMA), 2012)
afirma que la regulación ya fue expedida y sin mayor debate. Está
en circulación un segundo proyecto
y un resumen comparativo con el anterior, que hasta el momento,
parecen tener mejor acogida.
Ante
la utilidad parcial de todas las medidas mencionadas, la Federación
Médica Colombiana, propuso estudiar dos mecanismos adicionales inéditos
en Colombia: Negociación de Precios de Entrada y Compras
centralizadas.
La
negociación de precios de entrada (ex-ante) para obtener precios
iguales o mejores que el referente internacional a cambio del
acceso al mercado colombiano y las compras centralizadas (ex-post)
para mejorar términos de negociación y generar economías de
escala. Según la FMC, el experimento fallido de CAPREMED no debe
servir para abandonar la idea de las compras centralizadas, sino
para corregir el proyecto e implementarlo mejor.
En
cuanto a las medidas para regular el consumo, debe resaltarse la
inclusión inicial de Rituximab y Trastuzumab en el Plan
Obligatorio de Salud (POS), mediante el Acuerdo 29 de la Comisión
de Regulación en Salud (CRES) de 30 de diciembre de 2011.
Esta
medida, sin duda, cambia de bando a las Empresas Promotoras de
Salud (EPS),es decir, las pasa de “ser parte del problema” a
“ser parte de la solución”, con dos Anticuerpos monoclonales
muy importantes en recobros. Antes, las EPS podían recobrar estos
medicamentos biotecnológicos “a cualquier precio” y ahora
tendrán que pagarlos con recursos de la UPC,
que sin lugar a dudas, son más inelásticos. Si el experimento
resulta exitoso, se espera que se multipliquen las inclusiones de
este tipo de productos en el Plan Obligatorio de Salud (POS).
Finalmente,
el tema de los recobros ensombrece mucho más el panorama del
financiamiento de los biotecnológicos. Y tal como se dijo en la
introducción, no se tiene aún información depurada que permita
precisar el monto real efectivamente pagado durante la gestión
del “Consorcio Fidufosyga 2005”. La Superintendencia Nacional
de Salud, en respuesta a un derecho de petición de la FMC, dijo
que solo en los años 2007 a 2010 ese monto superó los COP
5.800.000.000.000. El Consorcio y el Ministerio del ramo -también
en respuesta a derechos de petición de la FMC- terminaron
aceptando que la información magnética de esos recobros NO
coincide con la documentación física de respaldo. Finalmente, el
nuevo administrador fiduciario Consorcio SAYP, dijo estar
revisando la información y hasta la fecha, no la entregó.
En
este contexto, la magnitud del problema puede intuirse con el análisis
de solo tres infografías difundidas por la FMC, que muestran el
caso de tres Anticuerpos monoclonales de la multinacional Roche,
con los estimados de sobreprecios mencionados al principio de este
informe, junto con datos de recobros. El primero de ellos,
Rituximab (Mabthera®) es emblemático porque se basa en datos que
la FMC cuestionó por tener valores unitarios superiores a COP 130
millones (cada ampolla!), fueron corregidos, y se incluyeron en
otra muestra de 170 recobros con valores unitarios superiores a
COP 100 millones y también se corrigieron.
Figuras
3 a 5: Infografías de sobreprecios y recobros de tres Anticuerpos
monoclonales
 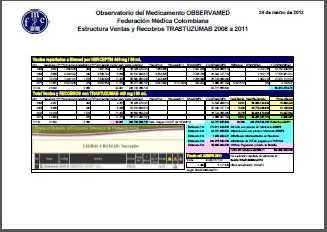
Ver
Infografía de Rituximab
(Mabthera®), Trastuzumab
(Herceptín®), Bevacizumab
(Avastin®).
De
acuerdo con estas infografías, en el cuatrienio 2008-2011, el
gasto social con Rituximab superó los COP 472.000 millones, con
Trastuzumab los COP 304.000 millones y con Bevacizumab los COP
201.000 millones. Una verdadera hemorragia financiera.
El
caso concreto de estos tres biotecnológicos puede considerarse
parcialmente resuelto por la vía de la inclusión en el POS de
los dos primeros y posible salida del mercado del tercero (por
cuenta de la FDA que negó su utilidad en las indicaciones
aprobadas en Colombia). Pero, con los demás medicamentos
biotecnológicos, el problema mantiene sus dimensiones apocalípticas,
para las finanzas de la salud pública.
Ver Informe
completo en PDF.
Ver Capítulo
4 de The invisible threat: trade, intellectual property
and pharmaceutical regulations in Colombia
Ver Nota
de prensa del 17 de julio de 2008
http://www.citizen.org/documents/Colombian%20court%20decision%20summary.pdf
Ver campaña de AFIDRO en Nota
de prensa 1, Nota
de prensa 2, Nota
de prensa 3, Presentación
Foro.
Ver Nota
de Portafolio.
Ver
el estudio de la serie Buscando Remedio, Impacto
de 10 años de protección de datos en medicamentos en Colombia
de la Fundación IFARMA.
Ver páginas 3 y 4 del documento Biológicos
y biotecnológicos: una oportunidad para Colombia del Dr. Luis
Guillermo Restrepo V.
Ver Archivo de reserva del 2°
Proyecto y del Resumen
comparativo.
Unidad de Pago por Capitación: Monto de recursos que el estado
asigna a las EPS para atender el plan de beneficios del POS.
|